基质胶与细胞因子技术指南:从基础原理到前沿应用的全面解析
基质胶的来源与分类
基质胶是从Engelbreth-Holm-Swarm (EHS)小鼠肉瘤中提取的基底膜基质复合物。这种天然来源的基质胶含有丰富的细胞外基质蛋白和生长因子,为细胞提供类体内的微环境。
制备过程:EHS肿瘤组织→匀浆→盐溶液提取→透析→冷冻干燥→液态基质胶(4℃保存)
物理性质:在低温(4℃)下是液态;当温度升高到室温或体温(37℃)时,会迅速聚合形成凝胶。
| 类型 | 特点 | 应用场景 |
|---|---|---|
| 标准型 | 含天然生长因子,促进多种类型细胞的分化 | 2D细胞培养(用于包被培养板、维持细胞特异性表型)、3D细胞培养(支持类器官形成、构建肿瘤球模型)、细胞功能实验(血管生成实验、细胞侵袭实验) |
| 生长因子减除型 (GFR) | 去除大部分生长因子、保留基底膜结构完整性 | 信号通路研究、基因表达分析 |
| 高浓度型(HC) | 蛋白浓度在18-22 mg/mL,高浓度的蛋白使基质胶更具基质刚度和支架完整性。 | 长期3D培养模型构建(类器官成熟与功能维持、干细胞长期分化实验)、高侵袭性细胞的侵袭实验、组织工程与再生医学研究、药物耐药性长期评估 |
| 类器官专用型 | 仿生成分设计、精准因子调控和长期结构稳定性 | 类器官的高效构建与长期维持(原代类器官培养、长期传代与功能成熟)、疾病模型与机制研究(肿瘤类器官建模、遗传疾病建模)、药物筛选与个性化医疗(药敏测试、毒性评估) |
| 干细胞专用型(ESC) | 仿生成分设计、信号调控适配性和高稳定性 | 干细胞的体外扩增与干性维持(胚胎干细胞/诱导多能干细胞培养、成体干细胞扩增)、干细胞定向分化研究、干细胞移植与细胞治疗研究 |
- 生产物料为不含LDEV病毒的小鼠肉瘤
- 经过微生物检测,未发现细菌、真菌和支原体
- 通过BCA方法测定蛋白浓度
- 通过鲎(hòu)试剂盒测定内毒素水平
- 在37 °C下进行7-14天凝胶稳定性测试
- 利用鸡胚本根神经节培养神经轴突生长试验测定基质的生物活性
基质胶的相关实验
血管生成指从已有血管形成新血管的过程,涉及内皮细胞增殖、迁移和管腔分化。在体外实验中,
-
基质胶提供类似基底膜的微环境,可诱导内皮细胞黏附、伸展并连接成网状结构;
-
内皮细胞在机制上响应促血管生成因子,通过整合素信号激活细胞骨架重组,6~18小时内形成管状网络。
1. 实验操作步骤:
- 细胞准备:将对数生长期培养的内皮细胞消化后,用含10%FBS的培养基重悬,调整浓度至2~3×10⁵ cells/mL(96孔板每孔接种2×10⁴细胞)。
- 铺基质胶:基质胶解冻后,按照每孔50-60μL的量加入预冷96孔板培养孔中,并轻轻摇晃培养板,使基质胶均匀铺于培养孔孔底,然后置于37℃细胞培养箱聚合30 min.
- 接种:将细胞悬液轻柔加入胶面(每孔50~100 μL),避免冲击胶体。37℃、5% CO₂培养箱中培养,6~18小时观察成管(时间因细胞状态和促血管因子浓度而异)。
- 定时观察:显微镜下观察成管情况,同时采集照片。
2. 结果示例:
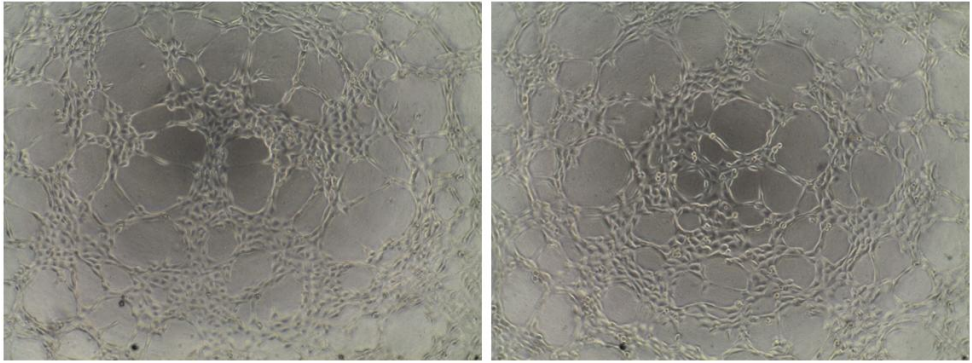
3.实验中可能使用的细胞因子
- 促血管生成核心细胞因子:血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)、血管生成素(Ang)等
- 协同调控因子:血小板衍生生长因子(PDGF)、转化生长因子-β(TGF-β)、表皮生长因子(EGF)、肿瘤坏死因子(TNF-α)等
- 其他辅助因子:胰岛素样生长因子(IGF)、肝细胞生长因子(HGF)等
研究细胞(尤其是肿瘤细胞、免疫细胞等)穿过基底膜或基质屏障能力的重要体外实验方法,常用于评估细胞的侵袭潜能、探究肿瘤转移机制或筛选影响细胞侵袭的药物等。
1.实验步骤( Transwell 法为例)
- 基质胶准备:将基质胶(如 Matrigel)在冰上融化,用无血清培养基稀释至合适浓度(通常 50-200 μg/μL,根据细胞类型调整)。向 Transwell 上室的微孔膜(孔径 8 μm,常用聚碳酸酯膜)上均匀铺展基质胶,37℃孵育 30-60 分钟使其凝固成胶状。
- 细胞处理与接种:收集对数期细胞,用无血清培养基重悬,调整浓度至 1×10⁵-1×10⁶ cells/mL;向上室加入细胞悬液(如 200 μL),下室加入含血清的培养基(作为趋化因子,如 500 μL),37℃、5% CO₂培养箱孵育(时间根据细胞类型调整,通常 24-72 小时)。
- 细胞固定与染色:孵育结束后,取出小室,用棉签轻轻擦去上室未穿过膜的细胞和残留基质胶;用甲醛或甲醇固定下室侧的侵袭细胞(15-30 分钟),再用结晶紫、苏木素或 DAPI 染色。
- 结果定量:显微镜计数,随机选取多个视野(如 5-10 个),计数染色的细胞数量,取平均值。
2.结果案例
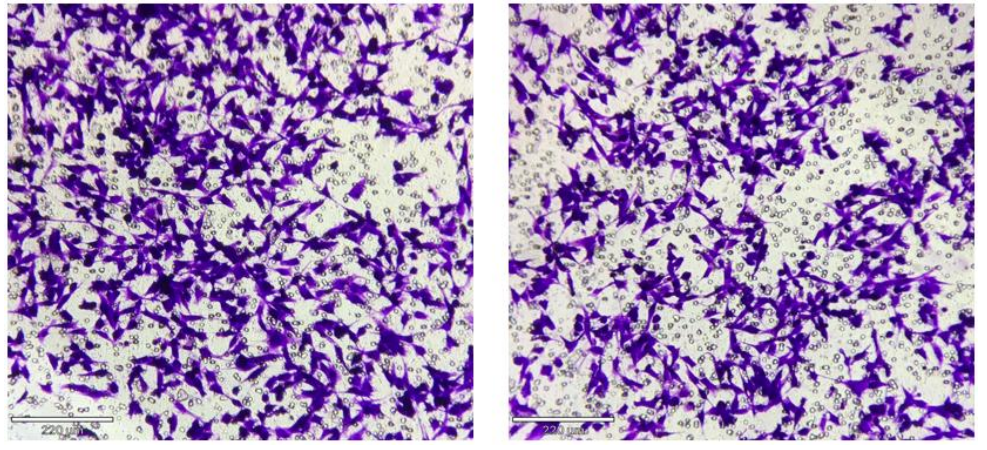
3.实验中可能使用的细胞因子
- 促侵袭核心细胞因子:转化生长因子 -β(TGF-β)、表皮生长因子(EGF)、血管内皮生长因子(VEGF)、肿瘤坏死因子 -α(TNF-α)等
- 协同调控因子:成纤维细胞生长因子(FGF)、血小板衍生生长因子(PDGF)、白细胞介素家族(ILs)等
- 其他辅助因子:肝细胞生长因子(HGF)、趋化因子(如 CXCL12/SDF-1)、基质金属蛋白酶诱导因子(EMMPRIN,CD147)
一种常用的体内血管生成研究模型。
通过将含有基质胶(Matrigel)及待检测因子(如促血管生成因子、药物等)的混合物皮下注射到实验动物体内,观察基质胶栓内血管形成的数量和质量,评估物质对血管生成的调控作用。
1.实验步骤
- 细胞处理与基质胶混合:选取对数生长期的细胞,消化细胞后用预冷的PBS洗两遍,细胞用预冷PBS或无血清培养基重悬,计数并根据需求调整细胞密度。细胞悬液与高浓度基质胶1:1混匀(如果细胞成瘤能力较高,基质胶终浓度可以降低)。一般皮下瘤接种的 细胞量为 1-5×10^6 个细胞/鼠,接种体积为 0.1-0.2 mL。
- 实验鼠准备:裸鼠周龄 4-6 周龄,体重 16-18 g 左右,种植部位选择血供丰富区域,如腋下中后部;从进针部位向前穿刺大约 1 cm,进行皮下注射,针头在皮下左右滑动几次,以便细胞接种成团,避免注射后细胞悬液从针眼溢出。
- 观察:接种后正常饲养,4-6 周成瘤,过程中检测小鼠体重,肿瘤体积变化;最后取瘤进行 拍照成像,保存组织用于下游实验检测
2.结果案例

3. 实验中可能使用的细胞因子
- 促血管生成核心细胞因子:血管内皮生长因子(VEGF)、成纤维细胞生长因子 - 2(FGF-2/bFGF)、血小板衍生生长因子 - BB(PDGF-BB)、血管生成素 - 1(Ang-1)
- 促肿瘤侵袭/转移相关细胞因子:转化生长因子 -β(TGF-β)、肿瘤坏死因子 -α(TNF-α)、肝细胞生长因子(HGF)
- 协同调控因子:白细胞介素 - 8(IL-8/CXCL8)、胰岛素样生长因子 - 1(IGF-1)、趋化因子 CXCL12(SDF-1)
利用基质胶作为载体,将肿瘤细胞植入小鼠皮下,模拟体内微环境并观察肿瘤生长,用于抗癌药物效价评估、肿瘤转移机制研究、细胞定植能力验证等。
1.实验步骤
- 实验材料准备:基质胶、实验动物、待检测物质
- 基质胶混合物制备:在冰浴的离心管中,将基质胶与待检测物质(或对照液,如 PBS)充分混匀,避免产生气泡(气泡会影响血管生成和后续观察)。
- 皮下注射:动物称重、标记,用异氟烷麻醉后,酒精消毒腹部或背部皮肤;用 1mL 注射器(预冷,避免基质胶提前凝固)吸取 0.2-0.5mL 基质胶混合物,缓慢注射到皮下(腹部中线两侧或背部肩胛区),注射后局部形成隆起的 “胶栓”。
- 取材与处理:通常在注射后 7-14 天(根据血管生成速度调整,如检测促血管生成因子可缩短至 5 天,抗血管生成药物实验可延长至 21 天)进行取材;处死动物后,用镊子完整剥离皮下的基质胶栓(此时胶栓已与周围组织部分粘连,含新生血管),称重、拍照记录外观(如是否红润,提示血管丰富程度)。
- 血管生成评估:组织学染色、定量分析
2.结果案例
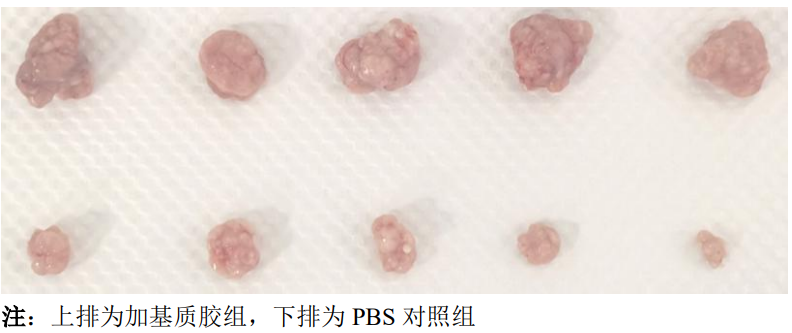
3. 实验中可能使用的细胞因子
- 促进肿瘤细胞存活与增殖的细胞因子:胰岛素样生长因子 - 1(IGF-1)、表皮生长因子(EGF)、转化生长因子 -α(TGF-α)
- 诱导肿瘤血管生成的细胞因子:血管内皮生长因子(VEGF)、成纤维细胞生长因子 - 2(FGF-2/bFGF)、血小板衍生生长因子 - BB(PDGF-BB)
- 调控肿瘤微环境的细胞因子:肿瘤坏死因子 -α(TNF-α)、白细胞介素 - 6(IL-6)、转化生长因子 -β(TGF-β)
一种利用干细胞或组织原代细胞在体外3D培养中自组装形成微型器官结构的技术,可模拟器官的生理结构、功能及疾病状态。
1.实验步骤
- 原代细胞/组织分离:手术样本/活检组织 → 剪碎成1 mm³碎片 → 胶原酶IV(1–2 mg/mL)消化30–60 min → 70 μm滤网过滤 → PBS洗涤。
- 基质胶包埋:细胞悬液 和基质胶(比例1:1)在冰上混合,24孔板中点胶,每孔中心加50 μL混合胶 ,37℃固化20 min;每孔加500 μL完全培养基(避免冲散胶滴)。
- 培养与传代:37℃、5% CO₂,每2–3天换液(吸旧液留1/3,避免胶滴干涸);基质胶包埋的类器官通常悬浮于培养基中;类器官生长至直径 500-1000μm 时(约 7-14 天),需用蛋白酶(如 TrypLE)或机械吹打分散为小块 / 单细胞,重新包埋于基质胶中培养(传代比例 1:3-1:5,根据生长速度调整)。
2.结果示例
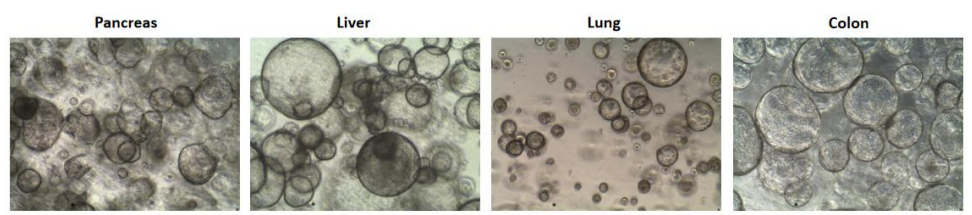
3. 实验中可能使用的细胞因子
- 通用型细胞因子:表皮生长因子(EGF)、成纤维细胞生长因子(FGF 家族,如 FGF-2/bFGF、FGF-7/KGF、FGF-10)、TGF-β 通路抑制剂(如 SB431542、A83-01)
- 器官特异型细胞因子:肠道类器官(R-spondin 1/3、Noggin、FGF-10)、脑类器官【bFGF(FGF-2)+ EGF、Sonic Hedgehog(Shh)、Wnt 抑制剂(如 IWR-1、DKK1)、神经营养因子(BDNF、NGF)】、肝脏类器官(肝细胞生长因子HGF、FGF-4)等
再生医学和疾病研究的核心技术。
1.实验步骤:
- 解冻:从-20℃把冰箱取出基质胶,将其半埋于碎冰之中(瓶扣朝上),并将冰盒置于 4℃ 冰箱过夜解冻。
- 分装:解冻后,轻轻摇匀基质胶,并结合每次实验基质胶需求量,分装基质胶,保留 1 管即用,其他的分装后立即转移至-20℃无除霜功能冰箱冻存
- 稀释:将基质胶按照预定比例用预冷 DMEM/F12 稀释(具体稀释比例需结合基质胶浓 度和预实验确定,通常稀释倍数在 50-100 之间)
- 包被:将稀释后的基质加入 6 孔培养板(1 mL/孔)或 100 mm 培养皿(8 mL/培养皿)。在 使用前请将培养皿在室温下(37℃)孵育 2 小时,待基质胶聚合后,使用前小心吸出培养皿中 剩余的液体,尽量避免刮擦培养表面。
- 接种:将制备好的 iPSC 细胞悬液接种到包被后的培养板或培养皿中,轻轻摇匀细胞, 于 37℃,5% CO₂培养箱中孵育培养,每天观察细胞状态并每天更换培养基。
2.结果示例:
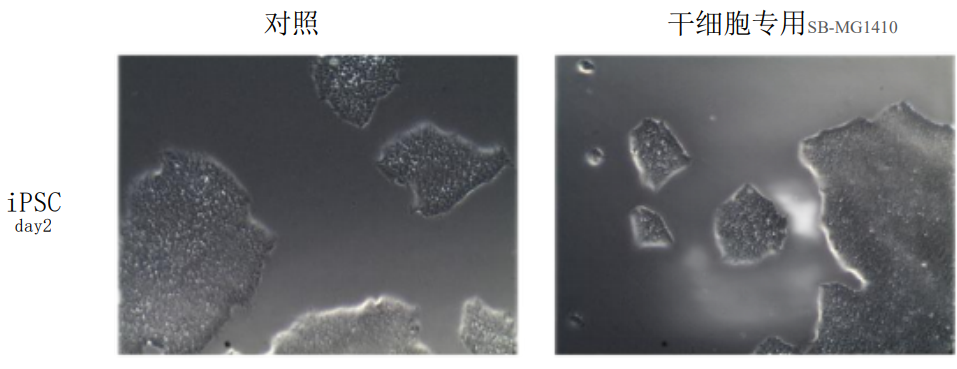
3. 实验中可能使用的细胞因子
- 维持干细胞干性与自我更新的细胞因子:白血病抑制因子(LIF)、碱性成纤维细胞生长因子(bFGF/FGF-2)、干细胞因子(SCF/c-Kit 配体)、转化生长因子 -β(TGF-β1/β3)
- 诱导干细胞定向分化的细胞因子:神经生长因子(NGF)、脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)、血管生成素 - 1(Ang-1)
- 促进干细胞存活与增殖的辅助因子:胰岛素样生长因子 - 1(IGF-1)、血小板衍生生长因子(PDGF-AA/BB)、白细胞介素 - 6(IL-6)
如何选择基质胶
1.明确实验需求:应用场景/细胞类型
2.关注基质胶成分与特性:成分来源、生长因子含量、凝胶硬度
3.实验兼容性与操作要求
4.成本与使用场景平衡
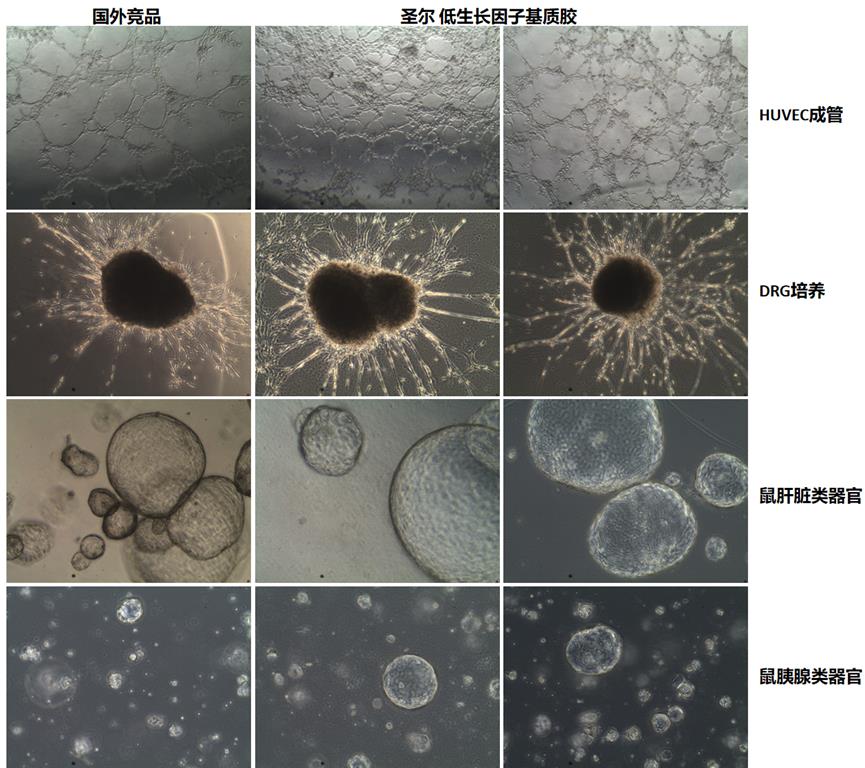
部分对比图展示
基质胶生物活性测试:
细胞因子的定义与分类
细胞因子是由免疫细胞(如淋巴细胞、巨噬细胞)和非免疫细胞(如内皮细胞、成纤维细胞)分泌的小分子信号蛋白(8-80kDa),在皮克/毫升浓度水平即可发挥强大生物学效应。
核心特征:
- 多效性:一种细胞因子可作用于多种细胞类型
- 冗余性:不同细胞因子可产生相似功能
- 协同性:多种因子联合作用增强效应
- 高效性:极微量即可激活细胞应答
| 类型 | 代表因子 | 主要功能 |
|---|---|---|
| 促炎因子 | TNF-α, IL-1β, IL-6 | 激活炎症反应,招募免疫细胞 |
| 抗炎因子 | IL-10, TGF-β | 抑制炎症,促进组织修复 |
| 趋化因子 | IL-8, MCP-1 | 介导细胞定向迁移 |
| 造血因子 | EPO, G-CSF | 调控血细胞生成 |
| 生长因子 | EGF, FGF, VEGF | 促进细胞增殖分化 |
- 白细胞介素(ILs):介导白细胞间通讯(已发现IL-1至IL-38)
- 干扰素(IFNs):IFN-α/β(抗病毒),IFN-γ(免疫激活)
- 肿瘤坏死因子(TNFs):TNF-α(促炎),TNF-β(淋巴毒素)
- 集落刺激因子(CSFs):G-CSF(粒细胞),M-CSF(单核细胞)
- 转化生长因子(TGFs):TGF-β(免疫调节,促纤维化)
细胞因子的检测方法
1.蛋白水平
-
ELISA:定量检测血清/培养上清中细胞因子浓度。
-
流式细胞术(CBA/胞内染色):多因子同步检测,分析分泌细胞亚群。
-
Western blot:检测细胞或组织裂解液中细胞因子蛋白表达,需特异性抗体,半定量分析
-
组织免疫荧光(IF)/ 免疫组化(IHC):定位细胞因子在组织中的表达位置
2.基因水平
-
qPCR:检测细胞因子mRNA表达。
-
单细胞测序:解析细胞因子基因在异质群体中的表达谱。
细胞因子的应用场景
细胞培养与功能研究
- 维持干细胞多能性:如白血病抑制因子(LIF)用于小鼠胚胎干细胞培养,保持其未分化状态。
- 诱导细胞分化:如骨形态发生蛋白(BMP)诱导间充质干细胞向成骨细胞分化;神经生长因子(NGF)促进神经元成熟。
- 调节免疫细胞活性:IL-2 刺激 T 细胞增殖,用于体外扩增免疫细胞(如 CAR-T 细胞制备);IFN-γ 激活巨噬细胞的杀菌功能。
疾病模型构建
- 炎症模型:TNF-α、IL-1β 诱导细胞炎症反应,研究关节炎、肠炎等疾病机制。
- 肿瘤研究:VEGF 促进肿瘤血管生成,用于构建肿瘤微环境模型;TGF-β 参与肿瘤细胞上皮 - 间质转化(EMT),模拟转移过程。
-
免疫调节与抗肿瘤治疗
- 造血与组织修复
- 炎症与自身免疫病干预
靶点验证与药效评估
- 靶点验证:抗体中和TNF-α治疗类风湿关节炎
- 药物筛选:基于细胞因子分泌谱的高通量筛选
- 生物标志物:IL-6水平作为炎症疾病活动指标
基质胶与细胞因子的协同作用
基质胶是细胞因子的天然载体与储存库
基质胶为外源细胞因子提供功能支架
基质胶与细胞因子的双向调控
- 基质胶影响因子表达
- 细胞因子改变基质胶性质
技术协同:构建“基质胶+细胞因子”功能互补体系
常见问题解答
Q1 为什么基质胶会有不同的颜色来呈现?
冻存或溶解状态下,基质胶会呈现草黄色或者深红色,因为一些亚型的基质胶中酚红,不同温度条件下,溶液pH值会变化,或者在使用过程中CO2会与磷酸盐缓冲液发生反应,影响溶液pH值,从而导致含酚红基质胶的颜色在草黄和深红之间变化。
Q2 基质胶解冻后正常外观是什么样的?
标准浓度基质胶解冻后,为粘稠溶液,浓度越高粘稠度越大;含酚红基质胶呈现粉红色,不含酚红为透明液态。高浓度基质胶由于浓度过高,溶液为浑浊粘稠样。
Q3 基质胶解冻需要多长时间,保存条件是什么?
- 基质胶解冻应该在2-8℃条件下进行(冰箱或者冷库),通常过夜解冻。
- 基质胶通常保存于-20 ℃无除霜功能冰箱,亦可保存-70 ℃超低温冰箱,但是超低温对玻璃瓶有一定要求,低温容易爆裂。
Q4 什么时候使用无酚红的基质胶?
如实验中涉及颜色分析、比色、荧光检测之类的检测,推荐使用无酚红基质胶,避免色素干扰;另外,酚红有雌激素类似效应,对于激素研究实验,推荐使用无酚红基质胶。
Q5 基质胶包被培养板后,能保存多久?
强烈推荐实验当天包被当天使用。包被后培养板加入无血清培养基后,可在37℃培养箱孵育保存1周。
Q6 如何稀释基质胶?
使用预冷无血清培养基或磷酸盐缓冲液(PBS pH 7.4),结合实验需求,稀释基质胶原液。
Q7 基质胶能反复冻融吗?
基质胶在反复冻融过程中会导致蛋白变性沉淀,影响基质胶生物活性以及蛋白浓度,所以建议收到基质胶后-20℃保存;或冰上解冻并结合实验计划进行分装,分装后小样-20 ℃保存备用。
Q8 基质胶中有少量沉淀怎么办?
基质胶出现少量沉淀属于正常现象,特别是高浓度基质胶,建议在分装前4℃低温低速离心处理(2000rpm/5min)。
Q9 如何减少基质胶批次间差异对实验的影响?
- 选用生长因子减除型(GFR)基质胶减少变量
- 同一实验使用同一批次产品
- 对新批次进行预实验测试关键参数
- 使用合成基质胶替代方案
- 建立内部质控标准(如凝胶时间、蛋白浓度)
Q10 细胞因子在实验中应该添加多少浓度?
细胞因子最佳浓度需根据具体应用优化:
- 细胞培养:通常1-100ng/mL
- 体内实验:0.5-5μg/kg体重
- 类器官培养:参考文献常用浓度梯度测试
注意:高浓度可能引起脱靶效应(如VEGF>100ng/mL导致血管渗漏)
Q11 基质胶操作有哪些关键注意事项?
- 全程低温操作:预冷枪头、离心管和培养板在冰上操作
- 避免气泡:混匀时轻柔吹打,不涡旋振荡
- 充分凝胶化:37℃孵育≥30分钟
- 浓度优化:类器官培养8-10mg/mL,Transwell实验≥10mg/mL
- 水化平衡:铺胶后加培养基37℃孵育1小时再接种细胞
Q12 细胞因子如何长期保存?
- 分装储存:使用前分装成小份,避免反复冻融
- 温度:-80℃长期保存,避免-20℃(部分因子不稳定)
- 复溶:按说明书用含载体蛋白的缓冲液复溶
- 工作液:4℃保存不超过1周
- 稳定性测试:定期检测活性(如细胞增殖实验)





