我们提供全面的RNA提取解决方案,从传统方法到最新试剂盒,满足各种样本类型和下游应用需求,确保您获得高质量RNA用于后续研究。
——常见RNA提取方法——
Trizol/酚氯仿法(有机溶剂抽提法)
原理:利用Trizol(苯酚和异硫氰酸胍)裂解细胞,加入氯仿分层后,RNA位于水相,通过异丙醇沉淀获得。
常见试剂:Trizol Reagent , Quazol™总RNA抽提试剂盒 SB-MR009
优点:得率高,可提取小RNA(如miRNA)
缺点:使用有毒有机溶剂,操作较繁琐
硅胶膜离心柱法(柱式法)
原理:高盐低pH条件下RNA吸附于硅胶膜,洗涤后低盐缓冲液洗脱。
常见试剂盒:细胞RNA快速提取试剂盒 SB-R001 组织RNA快速提取试剂盒 SB-R008
优点:操作简便,无有机溶剂
缺点:可能丢失小RNA(<200 nt)
磁珠法(磁珠吸附法)
原理:磁珠表面包被二氧化硅或羧基基团,高盐条件下结合RNA,磁场分离后洗脱。
常见试剂盒:Oligo(dT)22磁珠 SB-YX001
优点:适合自动化,高通量
缺点:成本较高,可能残留磁珠
——RNA提取方法及产品适用样本对比——
| 方法 | 原理 | 优点 | 缺点 | 适用样本 | 产品编号 |
|---|---|---|---|---|---|
| Quazol法(Trizol法) | 酚氯仿分层,异丙醇沉淀 |
适用范围广,可同时提取RNA/DNA/蛋白质 得率高,可提小RNA 稳定性好 成本低 |
有毒溶剂 操作复杂 耗时久 容易有盐和酚污染 |
细胞、动植物组织、细菌 | SB-MR009 |
| 除以上优点外,无需氯仿(使用氯仿替代物) | 细胞、动植物组织、细菌 | SB-MR010 | |||
| 柱式法 | 高盐吸附,低盐洗脱 |
操作简便 无有机溶剂(有毒试剂) 纯度高 时间短(10min) |
可能丢失小RNA 某些特殊样本效果不佳 |
动物、植物、真菌、血细胞 (不适用于全血及坚硬组织) |
SB-R001 |
| 多糖多酚植物 | SB-R010 | ||||
| 组织、细胞 | SB-R008 | ||||
| 石蜡包埋组织 | SB-NG311 | ||||
| 磁珠法 | 磁珠吸附,磁场分离 |
适合自动化 高通量 重复性好 |
成本高 可能残留磁珠 |
临床样本、高通量 | SB-YX001 |
——RNA提取的下一步应用方向——
Northern印迹分析
研究特定RNA分子的表达水平和大小,需要完整的RNA,特别是28S和18S rRNA比例正常。
实时定量PCR
精确测量基因表达水平,对RNA完整度要求较高,尤其是长片段转录本的分析。
cDNA文库构建
用于转录组研究或基因克隆,需要高质量RNA以避免偏向性。
RNA测序
新一代测序技术对RNA质量要求极高,降解的RNA会导致数据偏向3'端。
微阵列分析
需要足够量的完整RNA以获得可靠的杂交信号。
体外翻译系统
研究蛋白质合成机制,需要完整的mRNA。
——RNA提取操作关键注意事项——
专用工作区
设置RNA专用操作区,器具专用并定期除菌,在超净台中操作避免RNA酶污染。
个人防护
戴一次性橡胶手套并经常更换,避免说话聊天,可戴口罩防止唾液RNA酶污染。
器具管理
使用预灭菌无RNA酶耗材,避免共用器具,旧塑料制品需特殊处理去除RNA酶。
温度控制
全程冰上操作,低温离心。样品如不立即处理应液氮速冻保存于-80°C。
试剂管理
使用未开封新瓶配制溶液,确保足够Trizol用量,按比例调整小量样品体积。
关键操作
加氯仿后充分混匀,吸取上清宁少勿多,避免中间层污染,乙醇洗涤两次缩短操作时间。
——产品测评——
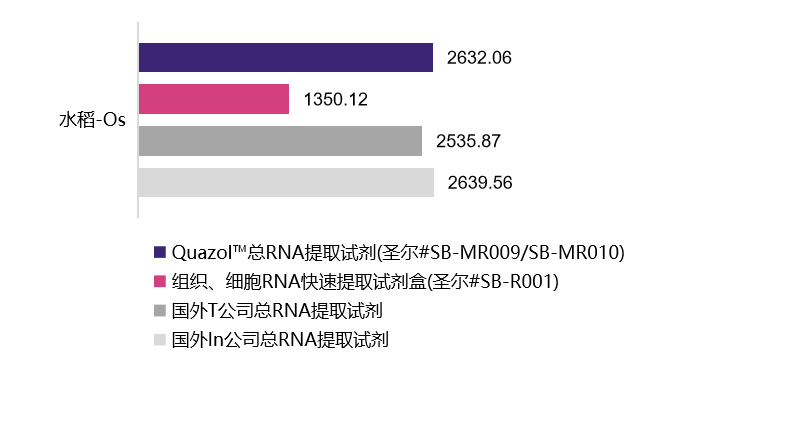
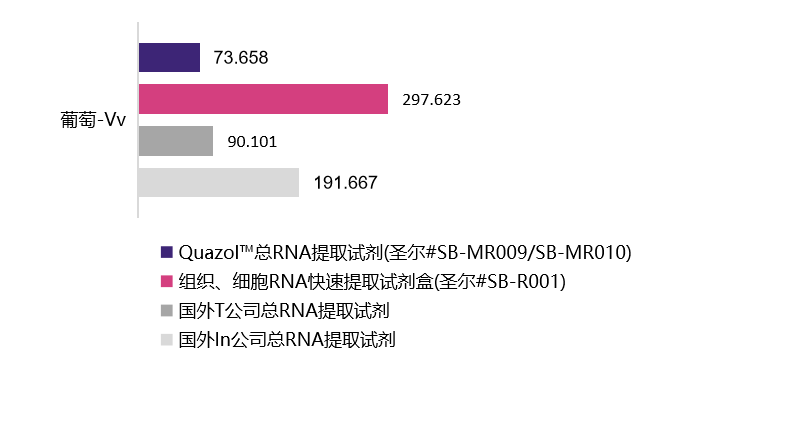
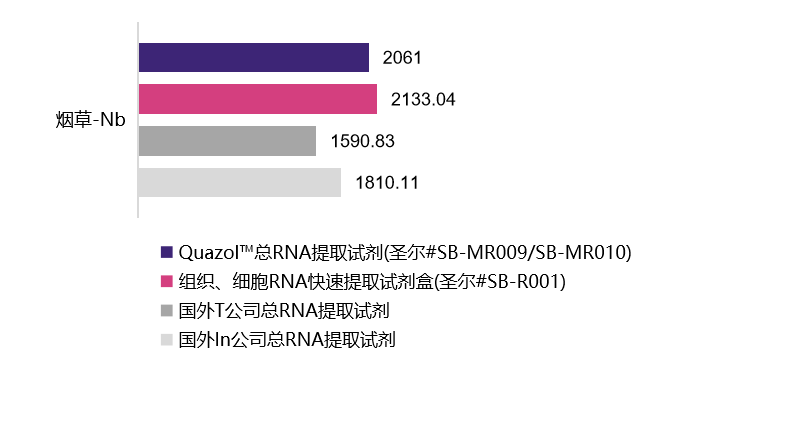
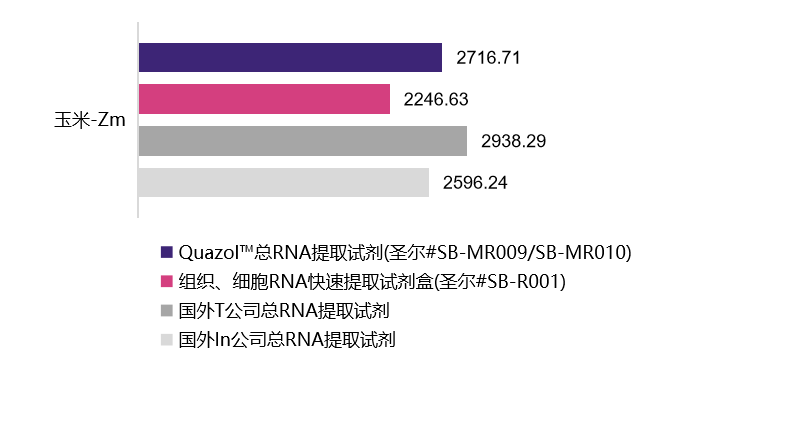
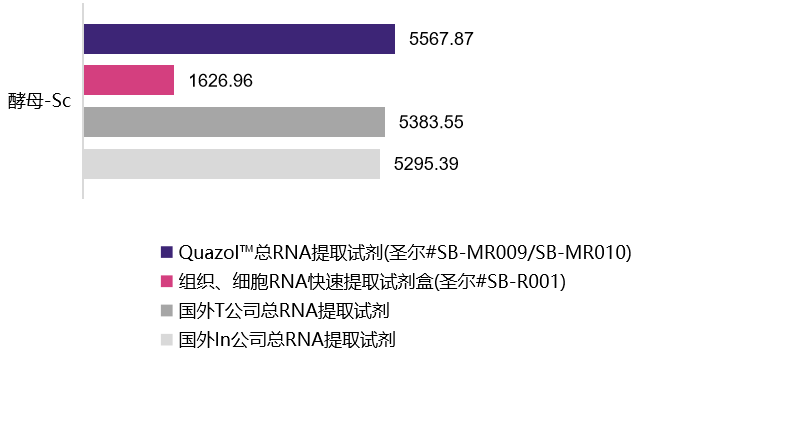
植物样本
| 水稻-Os | 葡萄-Vv | 烟草-Nb | 玉米-Zm | 酵母-Sc | |
|---|---|---|---|---|---|
| Quazol™总RNA提取试剂 (圣尔#SB-MR009/SB-MR010) |
2632.06 ng/mL A260/280=1.9 |
73.658 ng/mL A260/280=1.83 |
2061 ng/mL A260/280=1.96 |
2716.71 ng/mL A260/280=2.05 |
5567.87 ng/mL A260/280=1.91 |
| 组织、细胞RNA快速提取试剂盒 (圣尔#SB-R001) |
1350.12 ng/mL A260/280=2.18 |
297.623 ng/mL A260/280=1.99 |
2133.04 ng/mL A260/280=2.01 |
2246.63 ng/mL A260/280=2.04 |
1626.96 ng/mL A260/280=2.02 |
| 国外T公司总RNA提取试剂 | 2535.87 ng/mL A260/280=2.08 |
90.101 ng/mL A260/280=1.45 |
1590.83 ng/mL A260/280=2.12 |
2938.29 ng/mL A260/280=2.06 |
5383.55 ng/mL A260/280=1.71 |
| 国外In公司总RNA提取试剂 | 2639.56 ng/mL A260/280=1.97 |
191.667 ng/mL A260/280=1.97 |
1810.11 ng/mL A260/280=1.97 |
2596.24 ng/mL A260/280=1.97 |
5295.39 ng/mL A260/280=1.97 |
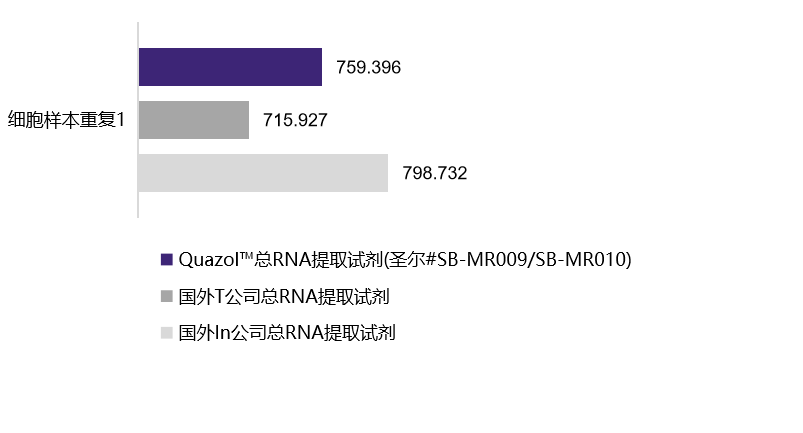
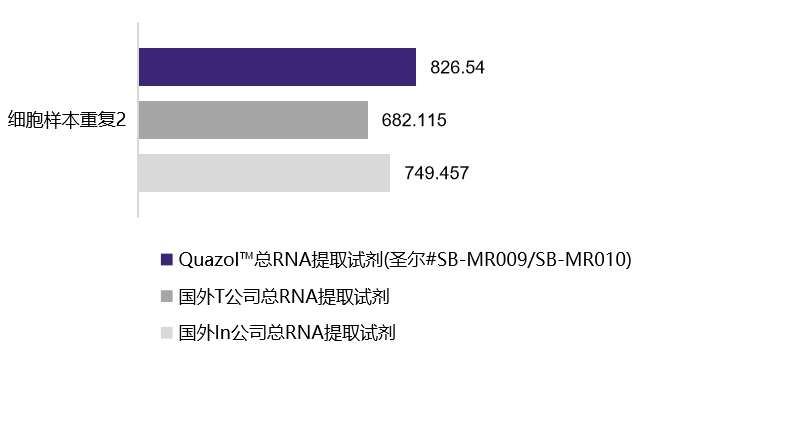
人前列腺癌细胞(22RV1)
| 22RV1(人前列腺癌细胞)-重复1 | 22RV1(人前列腺癌细胞)-重复2 | |
|---|---|---|
| Quazol™总RNA提取试剂 (圣尔#SB-MR009/SB-MR010) |
759.396 ng/mL A260/280=1.97 |
749.457 ng/mL A260/280=1.97 |
| 国外T公司总RNA提取试剂 | 715.927 ng/mL A260/280=1.96 |
682.115 ng/mL A260/280=1.94 |
| 国外In公司总RNA提取试剂 | 798.732 ng/mL A260/280=1.91 |
826.54 ng/mL A260/280=1.9 |
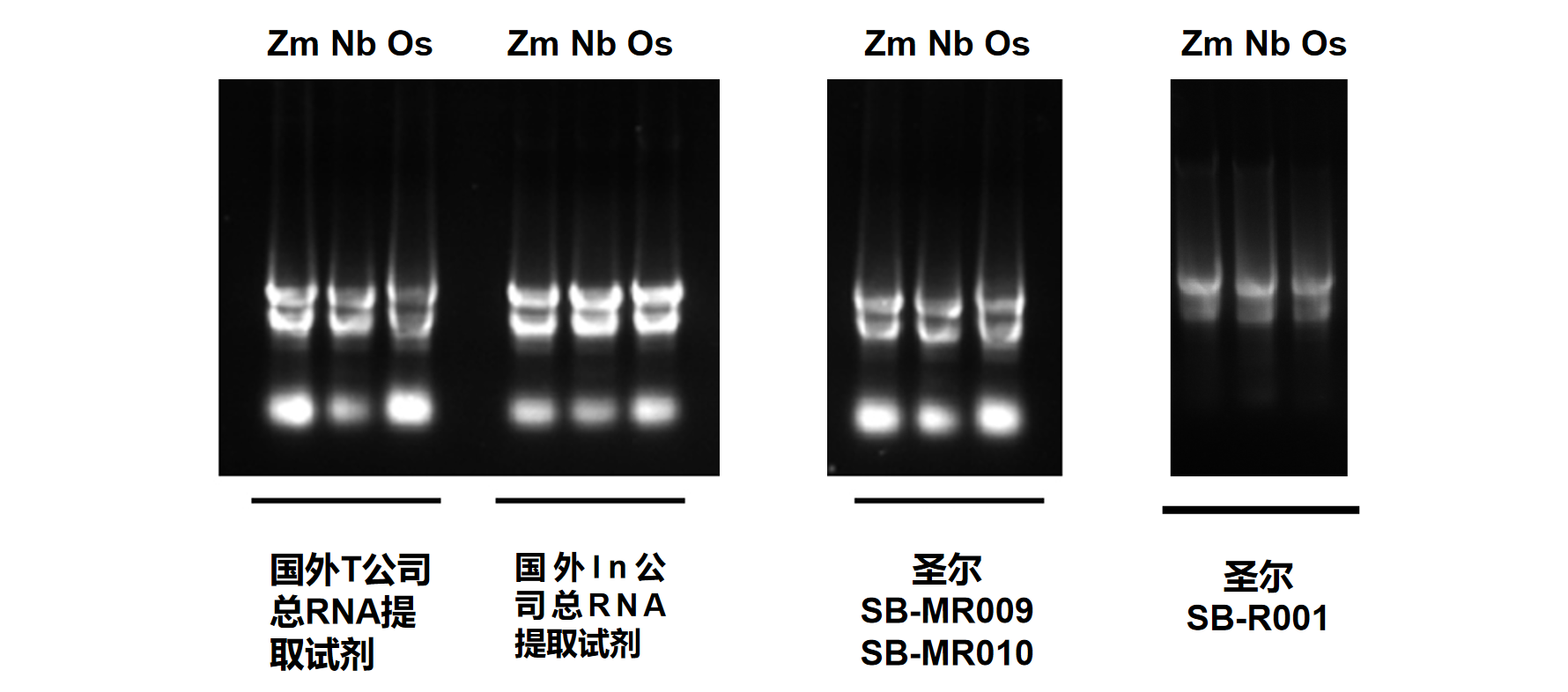
理想指标:A260/A280比值1.8-2.0表明蛋白质污染少。
RNA电泳结果示例:清晰的28S和18S条带。
选用植物组织样本及动物细胞在相同条件下进行的RNA提取,经浓度检测及A260/A280检测,结果表明,圣尔三款产品与进口产品相比,提取RNA的效果相当(R001为柱式法,产量低于有机溶剂抽提法),且均适用于植物组织与动物细胞RNA提取。
——RNA质量评估标准表——
| 评估方法 | 理想结果 | 可接受范围 | 不达标可能原因 |
|---|---|---|---|
| A260/A280比值 | 1.9-2.0 | 1.8-2.0 | 蛋白质污染(低)、酚残留(高) |
| A260/A230比值 | >2.0 | >1.8 | 酚、盐或其他有机物污染 |
| 28S/18S比值 | ~2:1 | ≥1.5:1 | RNA降解 |
| RIN值 | ≥9 | ≥7 | RNA降解或提取过程损伤 |
| 电泳图谱 | 清晰条带,无拖尾 | 可见28S和18S条带 | 降解或污染 |
——常见问题解答——
1. 为什么有时得不到RNA沉淀?
可能原因:
1) 匀浆不完全导致DNA分子大、溶液黏稠,蛋白和DNA复合物包裹RNA;
2) RNA过分稀释不能沉淀。
解决方案:
确保充分匀浆;小量样品按比例减少抽提溶液体积。
2. RNA提取率低可能是什么原因?
可能原因:
1) 系统超负荷导致匀浆不完全;
2) RNA不完全溶解;
3) 样品未及时处理或细胞生长过度激活RNA酶。
解决方案:
控制样品量;确保RNA完全溶解;样品立即处理或液氮冷冻。
3. A260/A280比值低于1.65说明什么?
可能原因:
1) 用水而非TE稀释;
2) Trizol或Quazol量太少;
3) 未室温放置5分钟;
4) 污染苯酚层;
5) RNA未完全溶解。
解决方案:
用TE稀释;确保足够Trizol或Quazol;按步骤操作;避免酚污染;充分溶解RNA。
4. 如何防止RNA降解?
关键措施:
1) 快速处理样品或立即冰冻保存;
2) 样品存于-70℃;
3) 使用无RNA酶器具;
4) RNA溶于TE中而非水;
5) 操作全程保持低温;
6) 使用RNA酶抑制剂。
5. 如何判断RNA电泳结果是否合格?
合格RNA电泳应显示清晰的28S和18S条带,28S亮度约为18S的2倍。条带模糊或比例异常表明RNA降解。
示例描述:"橄榄叶片提取的总RNA,经电泳检测,28S和18S两条带型清晰且28S rRNA的亮度大约是18S rRNA亮度的2倍,这说明分离得到的橄榄叶总RNA比较完整。