-
蛋白&免疫印迹
蛋白制备 蛋白电泳制胶试剂盒 Tris-Glycine玻璃板预制胶 Tris-Hepes玻璃板预制胶 Bis-Tris塑料板预制胶 大分子蛋白电泳套装(醋酸预制胶) 小分子蛋白电泳套装(Tricine预制胶) 非变性蛋白电泳套装( 非变性预制胶) 蛋白上样缓冲液 蛋白marker 电泳缓冲液&速溶颗粒 蛋白凝胶染色试剂蛋白转印 印迹孵育及检测 蛋白组学试剂蛋白提取试剂(蛋白组学) 蛋白酶(蛋白组学)蛋白电泳及转印仪器&零配件重组胰蛋白酶(质谱级) 重组赖氨酰内切酶(质谱级) IdeZ Protease(免疫球蛋白G降解酶) IdeS Protease(免疫球蛋白G降解酶) PNGase F((N-糖酰胺酶F或肽N-糖苷酶 F) Endo H(糖苷内切酶 H)相关耗材(蛋白组学)
- 抗体&抗原
- 免疫沉淀、免疫共沉淀试剂(IP、Co-IP)
- 免疫组化、免疫荧光
- ELISA 相关产品
- 分子生物学相关产品
- 染色液
- 检测试剂盒
- 细胞培养与检测
- 细胞资源库
- 常规试剂
- 标准溶液
- 动物实验
- 小动物成像
- 生化试剂
- 外泌体试剂
- 常用实验器材
- 圣尔生物明星产品
- 新品推荐
- 圣尔周边
- 技术服务
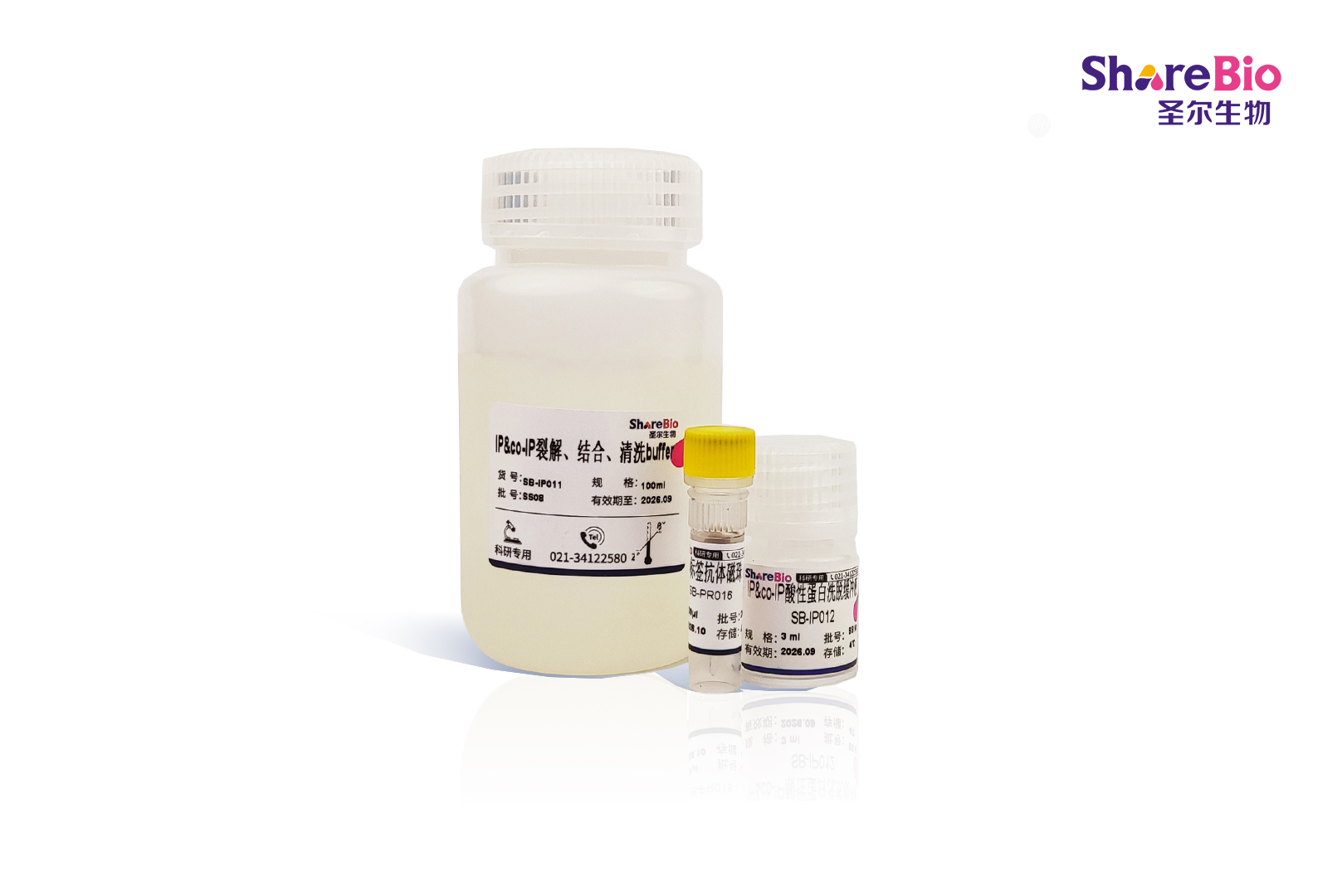
抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads
| 货 号 | SB-PR016 | ||
|---|---|---|---|
| 英 文 名 | Anti-His Tag Magnetic Beads | ||
| 规 格 | 1ml | ||
| 品 牌 | 圣尔生物share-bio | ||
| 一键复制产品信息 | |||
| 产品编号 | 名称 | 包装 | 品牌 | 目录价 | 促销价 | 货期 | 数量 | 购物车 |
| SB-PR016 | 抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads | 400μl | 圣尔生物share-bio | ¥650.00 |
|
|||
| SB-PR016 | 抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads | 1ml | 圣尔生物share-bio | ¥1300.00 |
|
|||
| SB-PR016 | 抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads | 2*1ml | 圣尔生物share-bio | ¥2500.00 |
|
|||
| SB-PR016 | 抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads | 5*1ml | 圣尔生物share-bio | ¥6000.00 |
|
抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads 介绍
| 产品详情 | 【产品概述】 His标签抗体磁珠是一种高性能亲和磁珠,由小鼠源单克隆抗体(抗His标签)与羧基磁珠偶联制备而成,具有高富集、低非特异性结合等特点,可特异性的与含有His标签的融合蛋白结合。适用于哺乳动物、植物、细菌、酵母、昆虫等各种生物的细胞提取物 【微珠属性】 适用范围 IP、co-IP、蛋白纯化 磁珠浓度 10 mg/mL 磁珠直径 1μm 适用抗体种属 His标签的融合蛋白 耐受高温 不耐高温 配基 完整抗体 【试剂准备】
搜索质检报告(COA)
搜索MSDS
暂无技术资料
抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads 说明书For research use only. Not intended for human and animal therapeutic or diagnostic use. 线上下单立享积分,加入圣尔会员,礼品随心兑!点击注册 抗His标签磁珠试剂盒(IP/Co-IP)Anti-His Tag Magnetic Beads 相关产品
|
|---|





